Das molare Volumen – Rechnen mit Volumen
Arbeitsblatt; „molares Volumen“
Satz von Avogadro :
Alle Gase enthalten bei gleicher Temperatur und gleichem Druck in gleichen Volumina die gleiche Teilchenzahl.
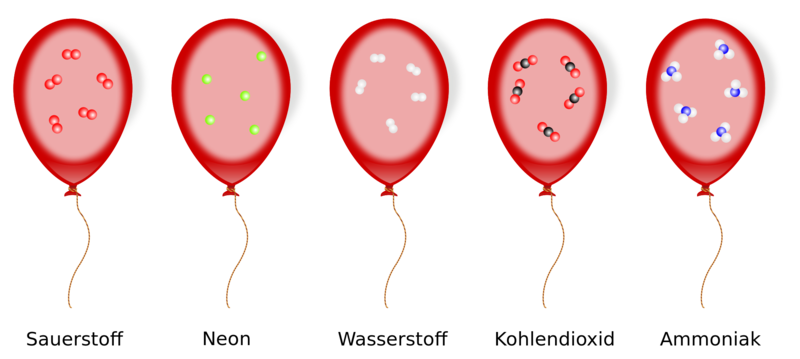
Daraus lässt sich ableiten, dass…
Jedes Gas nimmt für 1mol seiner Stoffmenge auch das gleiche Volumen ein!
Das molare Volumen beträgt für GASE :
V_m = 22,4 \frac{l}{mol}
Die molaren Volumina von Feststoffen und Flüssigkeiten sind jeweils unterschiedlich!
Was bedeutet diese Erkenntnis für das chemische Rechnen?
Sind Volumen von Gasen gegeben oder werden Volumen von Gasen gesucht, so kann man anstelle der Molaren Masse der Stoffe mit dem molaren Volumen rechnen! Und spart sich so beispielsweise den Rechenschritt Masse : Dichte = Volumen!
Beispiel:
Gegeben ist die Gleichung zur Oxidation von Schwefel:
S +O_2 \longrightarrow SO_2
Berechne das Volumen Schwefeldioxid, welches bei der Verbrennung von 5g Schwefel entsteht!
| Analyse: Ist der gesuchte oder der gegebene Stoff ein Gas? | Ja, der gesuchte Stoff Schwefeldioxid ist ein Gas! ►Also wird bei diesem Stoff die molare Masse durch das molare Volumen ersetzt! |
| Notiere für den gegebenen und den gesuchten Stoff : | geg: Schwefel ges: Schwefeldioxid |
| – die Stoffmenge (aus der Gleichung), | n_S =1mol ; n_{SO_2} = 1mol |
| – die gegebene Masse/ das gegebene Volumen (aus der Aufgabe) | m_S =5g ; V_{SO_2} = unbekannt! |
| -die molare Masse/das molare Volumen ( nur bei GASEN! ) (aus dem Tafelwerk) | M_S =32 \frac{g}{mol} ; V_{m} =22,4 \frac{l}{mol} |
| Rechnung | |
| Gleichung aus dem Tafelwerk suchen für: | Masse gegeben – Volumen gesucht |
| Größengleichung notieren! | \frac{V_{ges}}{m_{geg}} = \frac {n_{ges} \cdot V_m }{n_{geg} \cdot M_{geg}} |
| Größen einsetzen! | \frac{V_{ges}}{5g} = \frac {1mol \cdot 22,4 \frac{l}{mol} }{1mol \cdot 32 \frac{g}{mol}} |
| Gleichung lösen! Umstellen! (Wir multiplizieren beide Seiten mit 5g ) | V_{ges} = \frac {1mol \cdot 22,4 \frac{l}{mol} }{1mol \cdot 32 \frac{g}{mol}} \cdot 5g |
| Einheiten kürzen! Rechnen! Nur Liter bleibt erhalten! | V_{ges} = \frac {\not{1mol} \cdot 22,4 \frac{l}{\not{mol}} }{\not{1mol} \cdot 32 \frac{\not{g}}{\not{mol}}} \cdot 5\not{g} |
| Lösung: | V_{SO_2} = 3,5 l |
| (AWS) Antwortsatz: | Bei der Verbrennung von 5g Schwefel entstehen 3,5 Liter Schwefeldioxid. |
![]()
