Stoffgruppendefinition
![]()
Chemie kann man üben!

![]()
Markiere die richtige Stoffgruppe der fettgedruckten Substanz!
Leider kann man in diesem Quiz die Formeln nicht korrekt schreiben, deshalb steht hier H2O statt H_2 O
Bitte entschuldigt das.
Das geht auch analog. (zum Ausdrucken)
![]()
Zieh die Beschreibungen zur richtigen Stoffgruppe!
![]()
Zum Abschluss des Chemiekurses soll das erlangte Wissen auch verfügbar gemacht werden. Dazu ist es nötig, Analogien und Systematik aufzuzeigen. Die Gebiete Stoffe, Stoffgruppen, Reaktionen und technische Prozesse müssen für die Prüfung verfügbar sein. Das chemische Praktikum liefert eine gute praktische Vorbereitung auf die Prüfung.
Im Folgenden ein paar Anregungen zur Vorgehensweise:
Die Ordnung der Stoffe
Bei der Ordnung des Gelernten sollte man Stoffe nach folgenden Kriterien einteilen können…
Stoffe nach ihren Eigenschaften oder ihren Verwendungsmöglichkeiten einzuteilen, ist Sache desjenigen, der diese Einteilung vornehmen will. Eine allgemeine Einteilung nach diesen Kriterien kann es nicht geben.
Stoffe stellen die Gesamtheit der Materie dar, die uns umgibt.
Wir unterscheiden zunächst nur reine und gemischte Stoffe.
Für jeden Unterpunkt des Schemas lassen sich gesonderte Übersichten anfertigen. Denke zum Beispiel nur an das Schema, mit dem der Naturwissenschaftler arbeitet, um „Elemente“ genauer zu systematisieren, das PSE.
![]()

Betrachten wir die „andere“ Seite des PSE. Hier finden wir die Elemente „rechts“ der Bor-Astat-Linie.
Die Nichtmetalle sind Atomarten, die Elementsubstanzen aufbauen, die immer etwas „nicht metallisches“ an sich haben. So sind einige gasförmig bei Raumtemperatur oder sie leiten keinen elektrischen Strom, glänzen nicht oder sind schlechte Wärmeleiter. Irgendwas fehlt immer …
Einige Beispiele:
| Eigenschaften / Verwendungen | Kohlenstoff | Schwefel | Phosphor | Stickstoff |
|---|---|---|---|---|
| lateinischer Name/ Namensbedeutung | Carboneum / Holzkohle | Sulfur / langsam brennen, schwelen | Phosphorus /lichttragend, leuchtend | Nitrogenium/ salpeterbildend |
| Bau – Struktur der Modifikationen | Riesenmoleküle Graphit– geschichtet 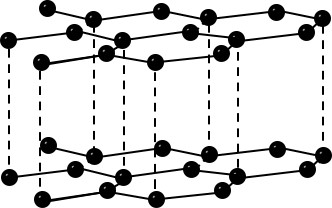 Diamant – Tetraedrisch dicht gepackter Kristall 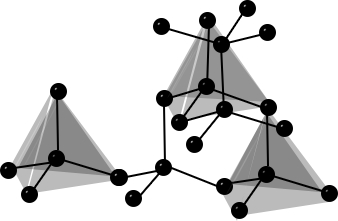 | 8-atomige räumlich orientierte Moleküle 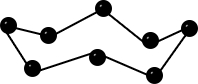 | Moleküle weiß – tetraedrisch 4-atomige Moleküle rot/schwarz – gewellte Doppelschichten 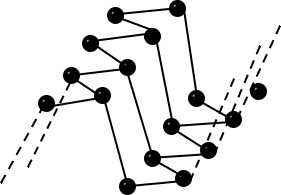 | 2-atomige Moleküle  |
| Dichte (g/cm³) | 2.267 | 2.07 | 1.82 | 1.251 |
| Schmelztemperatur (°C) | 3550 | 115 | 44.2 | -210.1 |
| Siedetemperatur (°C) | 4827 | 444.6 | 280 | -196 |
| Löslichkeit in Wasser | Unlöslich in Wasser | Unlöslich in Wasser, | Unlöslich in Wasser, | Unlöslich in Wasser, |
| Farbe | Schwarz, farblos | Gelb | Weiß, rot, schwarz | Farblos |
| Glanz | Diamant – lichtbrechend Graphit – grau glänzend | nein | nein | nein |
| Geruch | geruchlos | geruchlos | geruchlos | geruchlos |
| Brennbarkeit an der Luft | nicht brennbar | brennbar | brennbar | nicht brennbar |
| elektrische Leitfähigkeit | Graphit – ja Diamant – nein | nein | nein | nein |
| Verformbarkeit in der Kälte | nein | nein | nein | ja (gasförmig) |
| Verwendung | Schmuck (Diamant), Elektroden(Graphit), Kohlenstofffasern Bohr– und Schneidwerkzeuge (Diamant) | Schwefelsäure- und Düngemittelherstellung, | Düngemittel, Feuerwerkskörper, Flammenhemmer | Düngemittel, Kühlmittel, Ammoniakherstellung |
| natürliches Vorkommen | Diamanten- vulkanische Schlote und in Vergesellschaftung mit dem Mineral Kimberlit (Südafrika) | weltweit 1500 Fundorte (Polen, Sizilien,…) | weltweit in Form von Mineralien (Phosphate) | 78,1% der Luft |
Diese Atomarten bilden individuelle Elementsubstanzen von großer natürlicher, biologischer und technischer Bedeutung !
Beitrag: Kohlenstoff
Beitrag: Schwefel
Beitrag: Wasserstoff
Beitrag: Sauerstoff
Beitrag: Phosphor
![]()