chemische Zeichensprache 2
![]()
Chemie kann man üben!

![]()
Die Aufgabensammlung Stöchiometrie mit 10 Masse/Masse Aufgaben und ihre Lösungen.
Sollte ich mich doch irgendwo verrechnet haben, bitte ich um einen kleinen Tipp…
![]()
Voraussetzung für das Verständnis dieses Artikels ist die Kenntnis der folgenden Grundgesetze der Chemie:
Gesetz von der Erhaltung der Masse
Gesetz der konstanten Proportionen
Gesetz der multiplen Proportionen
Betrachten wir nun die Massenverhältnisse bei chemischen Reaktionen.
Reagiert Eisen (Fe) mit Schwefel (S) , so entsteht Eisensulfid (FeS).

Hier reagieren 1mol Eisen und 1 mol Schwefel zu 1 mol Eisensulfid.
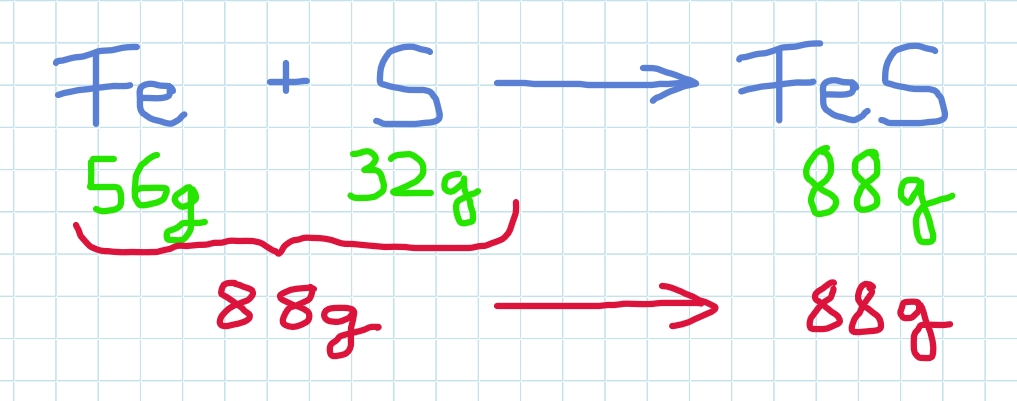
Es gilt lt. Masseerhaltungsgesetz:
Die Masse der Ausgangsstoffe ist gleich der Masse der Reaktionsprodukte!
Die eingesetzten 88g Eisen und Schwefel ergeben 88g Produkt Eisensulfid.
Halbierte man die eingesetzten Massen, so entstünde auch nur halb so viel des Produkts.
Plant man nun nur einen Teil der theoretischen Masse einzusetzen,
so erhält man auch nur einen Anteil der entstehenden Produktmasse.
Welche Masse Eisensulfid entsteht , wenn man nur 10g Eisen einsetzt?
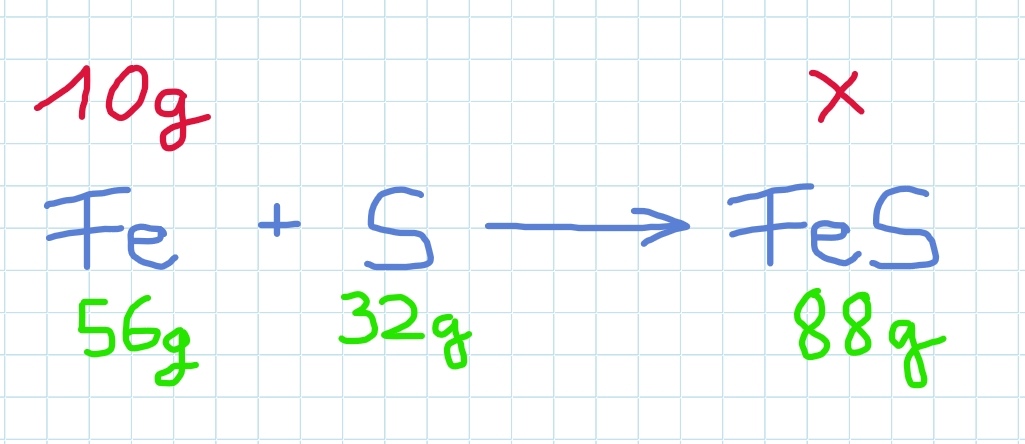
Der Schwefel spielt keine Rolle mehr…
Es entsteht eine Verhältnisgleichung für Eisen und Eisensulfid!

Nach Umstellung nach x ergibt sich…
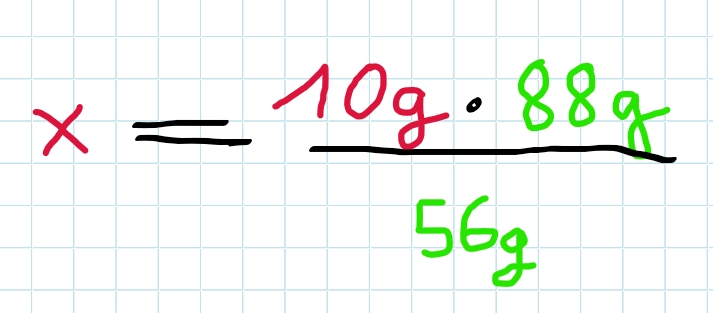
x = 15,714g
Antwortsatz:
Es entstehen also 15,4g Eisensulfid, wenn man 10g Eisen einsetzt.
Die Masse Schwefel, die einzusetzen ist, errechnet sich auf die gleiche Weise.
Ein weiteres Beispiel:
Reagieren Eisenoxid und Kohlenstoff miteinander, so entsteht Eisen und gasförmiges Kohlenstoffdioxid.
Dies geschieht in den hier dargestellten Verhältnissen:

Die einzusetzenden Massen betragen demnach…
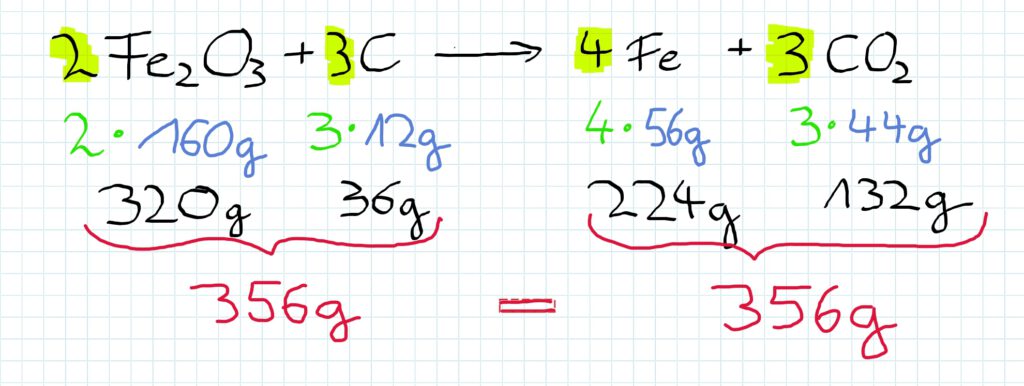
Die Koeffizienten vor den Formeln zeigen, dass ein doppelter oder gar dreifacher Anteil des Stoffes eingesetzt werden muss.
Welche Masse Eisenoxid ist einzusetzen, wenn man 10 kg Eisen produzieren will?
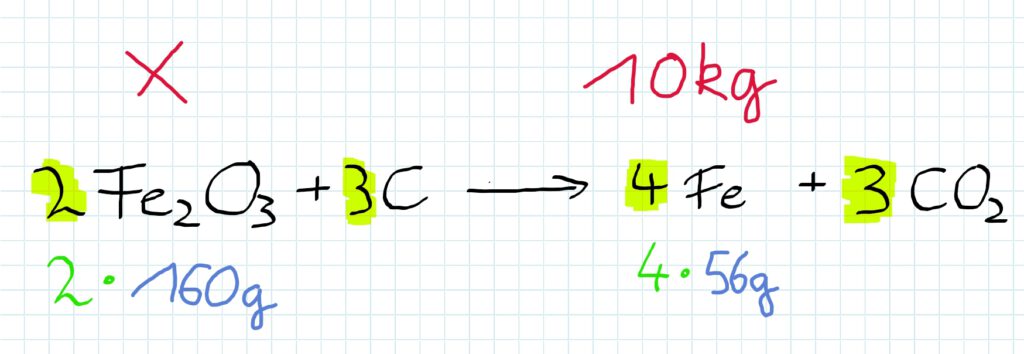
Nun ist nur noch das Verhältnis zwischen Eisenoxid und Eisen interessant…

Dafür ergibt sich die Rechenvorschrift:
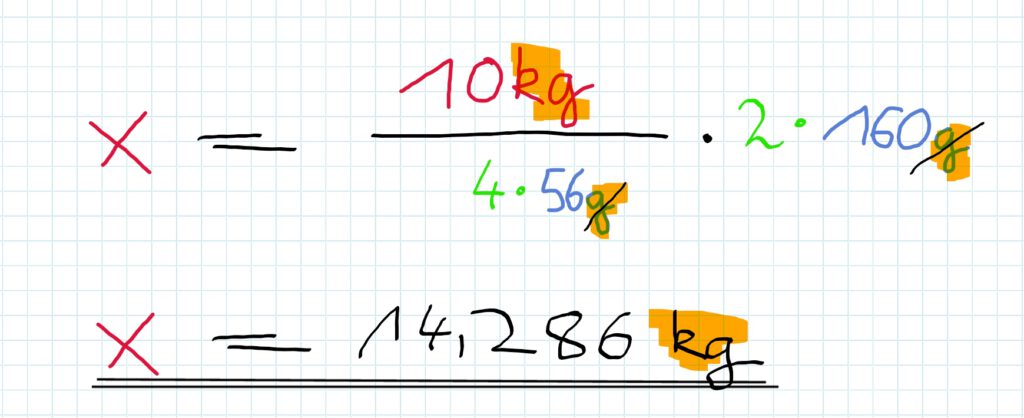
Antwortsatz:
Man muss also 14,286kg Eisenoxid einsetzen, um 120kg Eisen zu produzieren.
![]()
Zum Verständnis solltest Du Dich unbedingt vorher mit der Avogadrokonstante
beschäftigt haben und wissen, was sie Stoffmenge (n) ist.
Dank Herrn Loschmidt wissen wir :
„22,4 Liter Gas enthalten immer ein Mol dieser gasförmigen Substanz.“
So ergibt sich die Frage, nach einer Sammlung dieser Informationen.
Jemand müsste die Substanzen der Welt verdampfen und 22,4 Liter der idealen Gase wiegen.
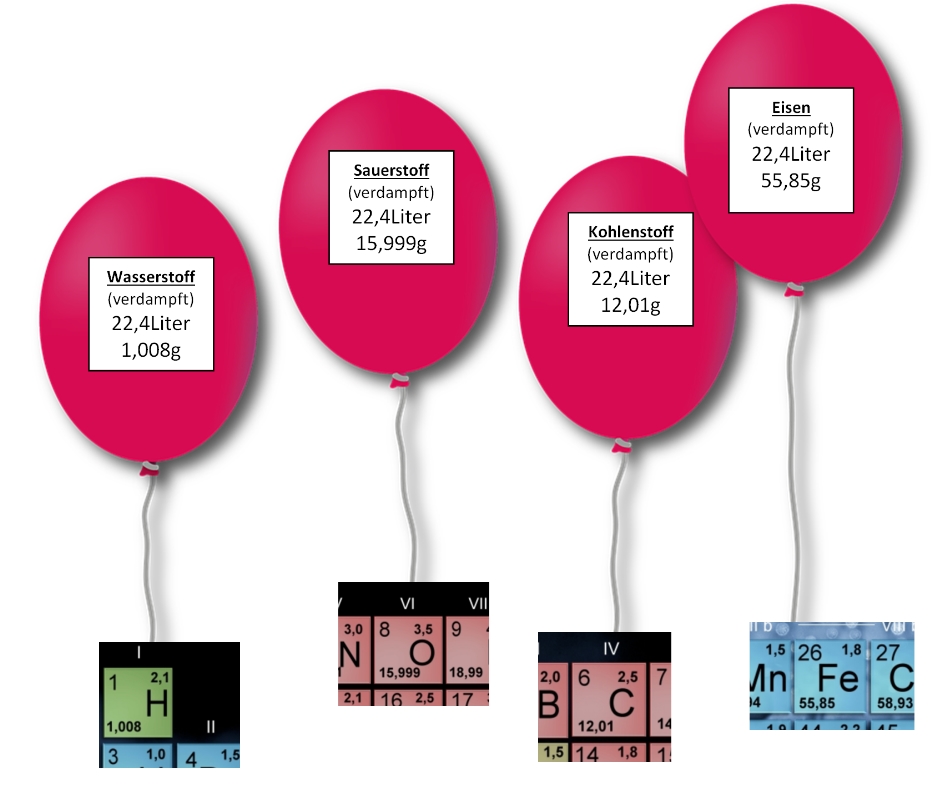
Diese Masse eines Mols einer Substanz nennt man die molare Masse M [g/mol]
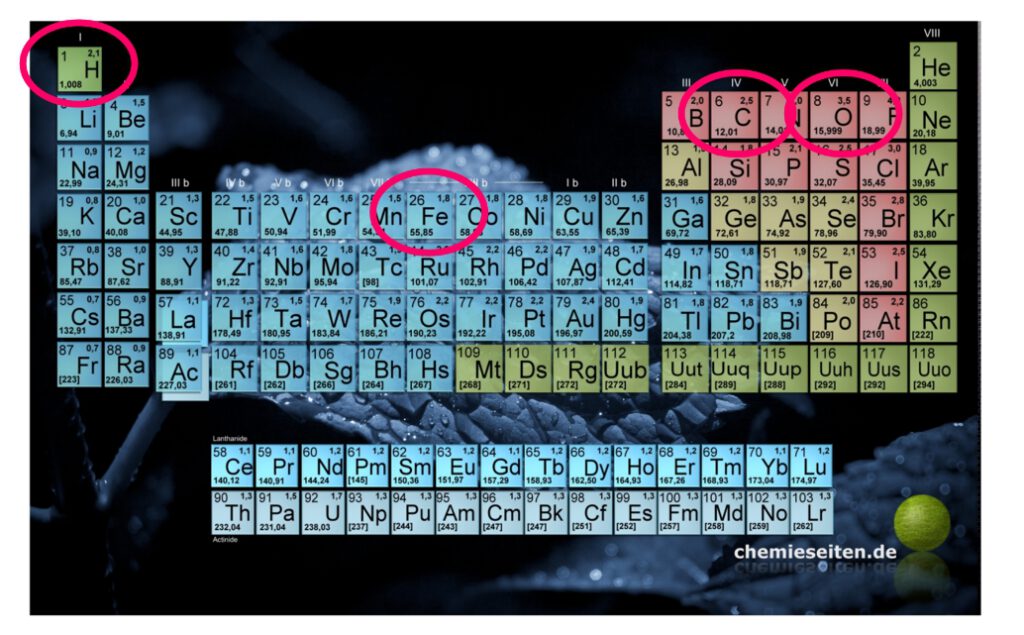
Man findet diese Angabe für alle Elemente als relative Atommasse im PSE!
1 mol Stickstoffatome [ 7N ] wiegen also 14,007 g
(Uns reicht die gerundete Zahl ohne Kommastellen zum Rechnen)
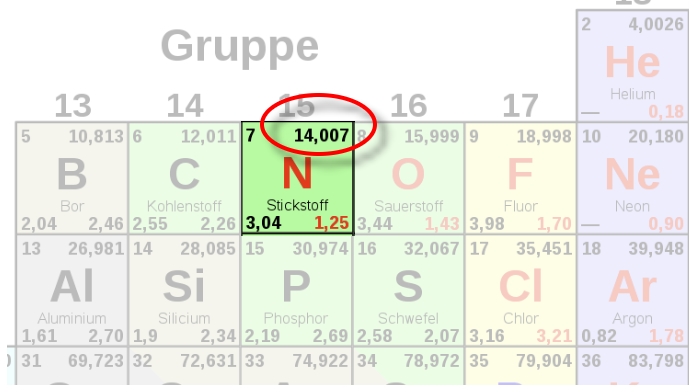
Für alle wichtigen Verbindungen kann man die Molare Masse im Tafelwerk nachschauen!
Die molaren Massen aller weiteren Substanzen muss man errechnen:
Die Formel der Stoffe ist dafür die Berechnungsvorschrift:
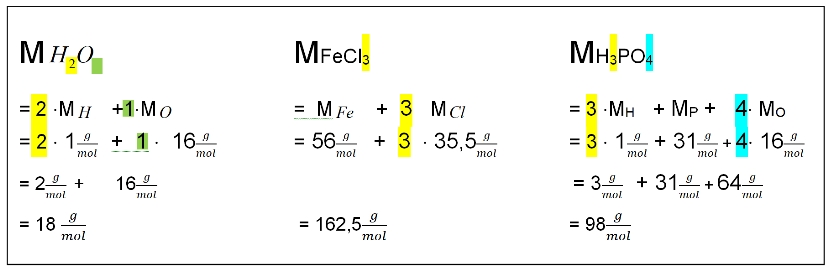
![]()

Schäfer haben mit der Erfahrung vieler Berufsjahre die Fähigkeit durch Clusterzählung ihre Herde auf „Vollzähligkeit“ zu prüfen. Bei Zählungen von bis zu 10.000 Tiere umfassenden Herden in Afrika nutzt man Hubschrauber und erfahrene „Zähler“ oder man fotografiert die Tiere und zählt anschließend am PC…
Man zählt hier also keine Einzelbestandteile, sondern fasst „kleinere Gruppen“ (Cluster) zusammen!
So ähnlich funktioniert das auch in der Chemie…
Aber mal von vorn…
Alle Gase enthalten bei gleichen Bedingungen in einem Volumen dieselbe Anzahl Teilchen.
Diese Erkenntnis verdanken wir Graf Amadeo Avogadro(1776–1856).
Das leichteste Gas ist Wasserstoff!
Stellt man also einem Liter Wasserstoff (0,089g) einen
Liter Sauerstoff (1,429g) gegenüber, so findet man …
$$ \frac{mO}{mH} = \frac{1,429g}{0,089g} = 16,056 $$
Das Sauerstoffteilchen ist 16– mal so schwer wie ein Wasserstoffteilchen.
Später wurden diese Verhältnisse noch genauer bestimmt und heute weiß man
Wasserstoff– und Sauerstoffteilchen stehen im Verhältnis von 1,008 zu 15,999!
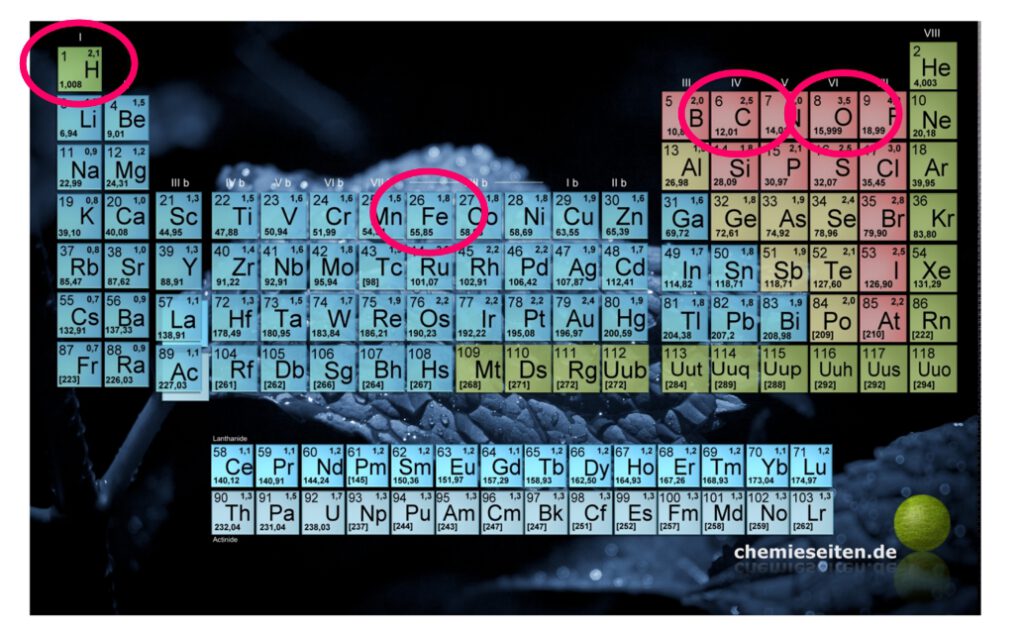
Wendet man dieses Verfahren auf alle verdampften Elemente an, so erhält man eine
Tabelle mit den Atom–Masseverhältnissen, wie im PSE zu sehen (relative Atommasse).
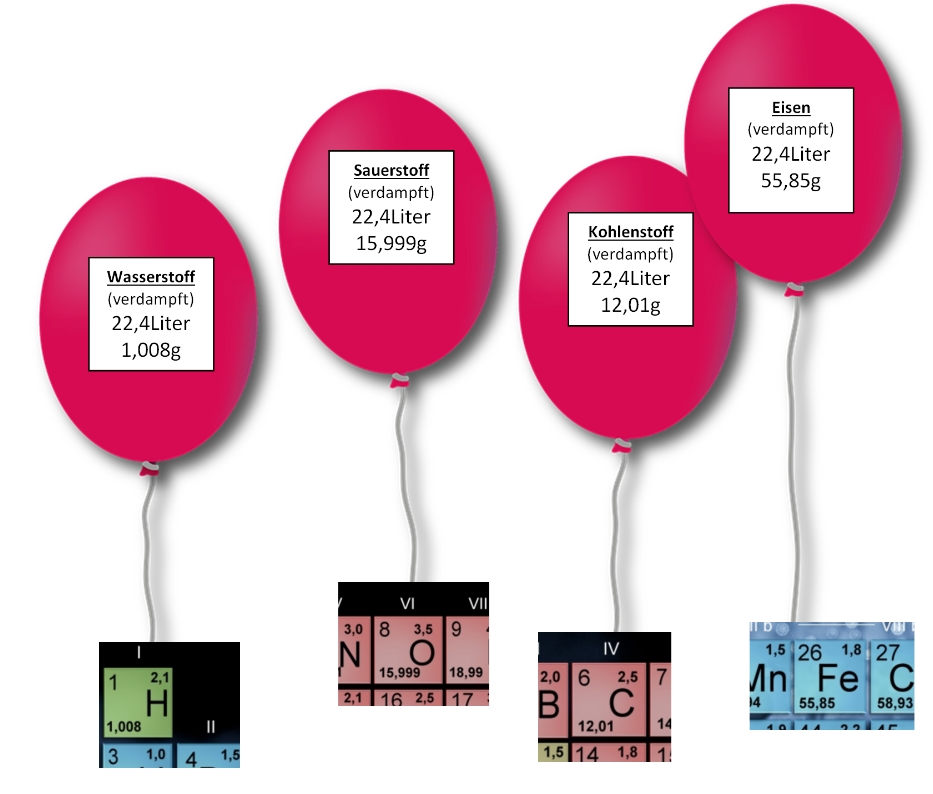
Ein gewisser Herr Josef Loschmidt (1821–1895) fand außerdem heraus, dass Wasserstoff (H2) bei 2g Masse aus genau 6,02214076 ×1023 Teilchen (hier Molekülen) besteht! Diese Vergleichsgröße ist in der Chemie unsere Clusterzahl … wir zählen Stoffe in „mol“, also in 602.214.076.000.000.000.000.000 Teilchen
(»6,022 ×1023), der sogenannten Stoffmenge n.
Weil niemand diese Zahl gern ständig schreibt,
nennt man diese Anzahl Teilchen die
Stoffmenge „ein Mol“!
Uns reicht eine Angabegenauigkeit von 6 ×1023.
1 mol Wasserstoff 1 mol H2 enthält 6 ×1023 Teilchen
6 mol Argon 6 mol Ar enthalten 6 × 6 ×1023 Teilchen
20 mol Eisenoxid 20 mol Fe enthalten 20 × 6 ×1023 Teilchen
4,5 mol Kohlendioxid 4,5 mol CO2 enthalten 4,5 x 6 ×1023 Teilchen
Teilchen heißt.. bei Metallen – Atome, beim Wasserstoff – Moleküle und in einer Verbindung wie Kochsalz (NaCl) – Formeleinheiten
![]()