Luft (Liveworksheet)
liveworksheets.com
https://www.liveworksheets.com/td1602720id
![]()
Chemie kann man üben!

https://www.liveworksheets.com/td1602720id
![]()



Stickstoff hatte schon viele Namen wie zum Beispiel „schlechte Luft“. Es hieß früher auch „Azot“, „Azotum“, „Stickgas“ oder „Zoogenium“. Das Symbol „N“ bezieht sich auf den lateinischen Namen „Nitrogenium“. Dies ist von „Herkunft des Laugensalzes“ abgeleitet.
Sein elementares Vorkommen in der Luft wurde 1771 von Carl Wilhelm Scheele nachgewiesen. Dort bildet es bei Raumtemperatur ein Gas aus zweiatomigen Molekülen (N_2) . Aus diesem Gas besteht die Luft zu 78%.
Stickstoff kommt in der Natur in den Strukturen von Eiweißen und dem Salz Salpeter vor. Salpeter war bis in das beginnende 20. Jahrhundert die Hauptquelle zur Herstellung von Stickstoffverbindungen. Die stickstoffhaltigen Salze werden von den Menschen schon seit Jahrtausenden genutzt und hergestellt. Diese Nitrate und Ammoniumsalze finden sich in der Erdkruste, sind aber auch aus tierischen Exkrementen herstellbar. Schon im antiken Ägypten stellte man sie aus Kameldung oder dem Boden von Ställen her. In Südamerika erfolgt die Herstellung bis heute aus über Jahrhunderte abgelagerten Vogelkot (Guano).
So stehen uns die Stickstoffverbindungen über diese Salze und Naturstoffe zur Verfügung. Ammoniak, Salpetersäure und Stickstoff-Düngemittel sind die wichtigsten Produkte aus Stickstoff. Das 1913 erfundene Verfahren zur Ammoniakherstellung erlangte als Haber-Bosch-Verfahren Weltruhm.
Experimente mit Stickstoff
Anwendung : flüssiger Stickstoff hilft bei der Reparatur von Rohrleitungen – Rohrfrosten
![]()

Betrachten wir die „andere“ Seite des PSE. Hier finden wir die Elemente „rechts“ der Bor-Astat-Linie.
Die Nichtmetalle sind Atomarten, die Elementsubstanzen aufbauen, die immer etwas „nicht metallisches“ an sich haben. So sind einige gasförmig bei Raumtemperatur oder sie leiten keinen elektrischen Strom, glänzen nicht oder sind schlechte Wärmeleiter. Irgendwas fehlt immer …
Einige Beispiele:
| Eigenschaften / Verwendungen | Kohlenstoff | Schwefel | Phosphor | Stickstoff |
|---|---|---|---|---|
| lateinischer Name/ Namensbedeutung | Carboneum / Holzkohle | Sulfur / langsam brennen, schwelen | Phosphorus /lichttragend, leuchtend | Nitrogenium/ salpeterbildend |
| Bau – Struktur der Modifikationen | Riesenmoleküle Graphit– geschichtet 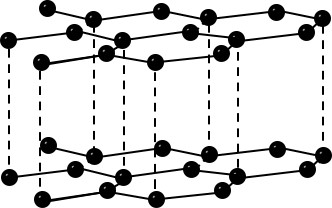 Diamant – Tetraedrisch dicht gepackter Kristall 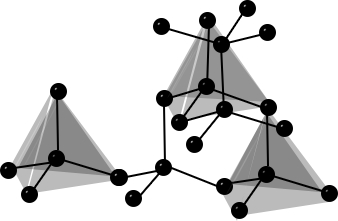 | 8-atomige räumlich orientierte Moleküle 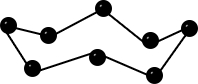 | Moleküle weiß – tetraedrisch 4-atomige Moleküle rot/schwarz – gewellte Doppelschichten 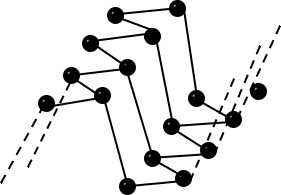 | 2-atomige Moleküle  |
| Dichte (g/cm³) | 2.267 | 2.07 | 1.82 | 1.251 |
| Schmelztemperatur (°C) | 3550 | 115 | 44.2 | -210.1 |
| Siedetemperatur (°C) | 4827 | 444.6 | 280 | -196 |
| Löslichkeit in Wasser | Unlöslich in Wasser | Unlöslich in Wasser, | Unlöslich in Wasser, | Unlöslich in Wasser, |
| Farbe | Schwarz, farblos | Gelb | Weiß, rot, schwarz | Farblos |
| Glanz | Diamant – lichtbrechend Graphit – grau glänzend | nein | nein | nein |
| Geruch | geruchlos | geruchlos | geruchlos | geruchlos |
| Brennbarkeit an der Luft | nicht brennbar | brennbar | brennbar | nicht brennbar |
| elektrische Leitfähigkeit | Graphit – ja Diamant – nein | nein | nein | nein |
| Verformbarkeit in der Kälte | nein | nein | nein | ja (gasförmig) |
| Verwendung | Schmuck (Diamant), Elektroden(Graphit), Kohlenstofffasern Bohr– und Schneidwerkzeuge (Diamant) | Schwefelsäure- und Düngemittelherstellung, | Düngemittel, Feuerwerkskörper, Flammenhemmer | Düngemittel, Kühlmittel, Ammoniakherstellung |
| natürliches Vorkommen | Diamanten- vulkanische Schlote und in Vergesellschaftung mit dem Mineral Kimberlit (Südafrika) | weltweit 1500 Fundorte (Polen, Sizilien,…) | weltweit in Form von Mineralien (Phosphate) | 78,1% der Luft |
Diese Atomarten bilden individuelle Elementsubstanzen von großer natürlicher, biologischer und technischer Bedeutung !
Beitrag: Kohlenstoff
Beitrag: Schwefel
Beitrag: Wasserstoff
Beitrag: Sauerstoff
Beitrag: Phosphor
![]()
Benachrichtigungen