Redoxreaktion Kupferoxid + Kohlenstoff
Aufrufe 4968 total views
Chemie kann man üben!

Aufrufe 4968 total views
Bei jeder chemischen Reaktion finden Prozesse der Energieumwandlung statt. Da jede Substanz ein gewisses Potential hat, das chemische Energie genannt wird, können bei Prozessen Wärme, Licht, elektrischer Strom oder Bewegungsenergie in Erscheinung treten.
exotherm
Prozesse, die mehr Energie liefern(abgeben)
als sie zugeführt bekommen, heißen „exotherm„.
Die Verbrennungsprozesse von Holz, Kohle, Benzin und Diesel, Heizöl oder Wasserstoff sind exotherme Prozesse.
Auch das Lösen von Natriumhydroxid (NaOH) in Wasser oder das Verdünnen von Säuren verlaufen unter Erwärmung des Lösungsmittels.
Anwendungsbeispiel:

Video zu den heißen Dosen
endotherm
Prozesse, die mehr Energie zugeführt bekommen,
als sie abgeben heißen „endotherm„.
Der berühmteste endotherme Prozess ist nur aktiv, wenn die Energiequelle Sonnenlicht verfügbar ist. Nachts stoppt der Prozess. Die Pflanzenwelt unseres Planeten nutzt die Photosynthese um aus Kohlendioxid und Wasser den Energiereichen Stoff Glucose(Traubenzucker) herzustellen und liefert das Nebenprodukt Sauerstoff. Lebensnotwendig für die Tierwelt.
Ein Salz, welches beim Lösen in 20°C warmem Wasser dem Lösungsmittel die Wärme entzieht, ist zum Beispiel Kaliumnitrat. Das Wasser kühlt bei Zugabe des Salzes ab. Die ersten Verfahren Erzeugung von Kälte waren die sogenannten Kältemischungen, bei denen man solche Salze mit Eis,Schnee oder Wasser mischte. So konnte man mit den unterkühlten Flüssigkeiten andere Gegenstände kühlen oder auch Wasser gefrieren. Die Idee des Kühlschrankes war nur noch einen Schritt entfernt.
Beispiel für eine endotherme Reaktion:
weitere Versuche zu „exotherm“ und „endotherm„:
Aufrufe 9519 total views
Laufen Oxidation und Reduktion in einem System gleichzeitig ab, so nennt man diesen Prozess eine
REDuktions-OXidations –Reaktion oder kurz REDOX –Reaktion.
Voraussetzung ist, es gibt ein Oxid und einen Hilfsstoff, der den Sauerstoff des Oxids aufnehmen kann. So ein Stoff hilft, das Oxid zu reduzieren, er ist ein Reduktionsmittel und wird bei dem Prozess selbst oxidiert. Das Oxid selber ist also ein Oxidationsmittel.
Bei der RED-OX-Reaktion wird ein OXID reduziert und ein Hilfsstoff oxidiert.
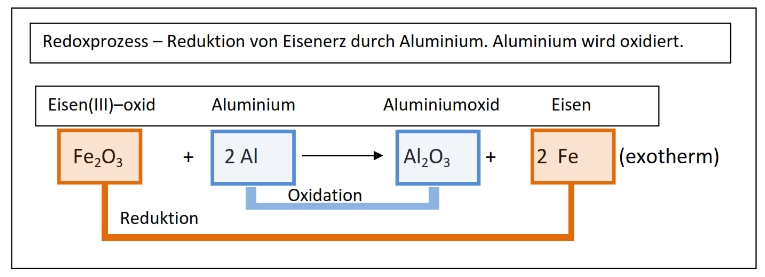
Hier wird Eisenoxid durch Aluminium reduziert. Es entsteht Eisen.
Das Aluminium nimmt dabei den Sauerstoff auf und wird zu Aluminiumoxid oxidiert.
Hans Goldschmidt – Thermitverfahren

Die Versuche des Herrn Hans Goldschmidt zu Redox-Prozessen führten vor über 100 Jahren zu neuen Erkenntnissen in der Metallurgie . Dabei wurden Oxide von stark nachgefragten Metallen, wie Chrom, Mangan und dem Halbmetall Silizium in einer Hochtemperatur-Reaktion aus ihren Oxiden hergestellt.
So stellte Herr Goldschmidt ein Verfahren vor, mit dem es möglich sein sollte, eine gebrochene Eisenbahnschiene innerhalb weniger Arbeitsstunden zu schweißen. Für damalige Verhältnisse undenkbar, da der Austausch der Schiene Tage dauerte und zum „Schweißen“ flüssiger Stahl – also 1800°C heiß – vor Ort sein müsste. Eine Demonstration des Goldschmidtverfahrens fand weltweite Aufmerksamkeit.
Heute wird dieses Verfahren – das „aluminothermische Schweißen“ – weltweit eingesetzt, da es immer noch die einfachste Art ist, flüssigen Stahl in kleinen Portionen an jedem Ort der Welt herzustellen um Schienenstöße miteinander zu verbinden und Reparaturen durchzuführen.
Der Schienenstrang wird von einer Form umgeben und vorgewärmt. Dann wird das Reaktionsgefäß mit dem Eisenoxid- Aluminium – Gemisch aufgesetzt. Die Reaktion des Gemisches wird mit einer Zündkirsche aktiviert und läuft dann stark exotherm von selbst ab. Die Schlacke – das aluminiumoxidhaltige Nebenprodukt – läuft in die seitlichen Schalen. Später wird die Gussform entfernt und die Bruchstelle entgratet.
Weiter zur Eisengewinnung durch den Hochofenprozess…
REDOX-Reaktion von Kupferoxid + Kohlenstoff
Aufrufe 5146 total views
Materialien, die den Umwelteinflüssen ausgesetzt sind, verwittern. Die stille, langsame Reaktion mit dem Sauerstoff der Luft und der Hilfe von Wasser in Form von Regen, Schnee und Eis, Kälte und Hitze betrifft Stoffe, wie Metalle, Glas, Kunststoffe, Farben und Lacke, Textilien und viele mehr.
Bei den Metallen sprechen wir vom „Rosten“ oder dem „Korrodieren“.
Der Begriff „Korrosion“ ist jedoch international auch mit „corrosive“ – zerstörend oder ätzend belegt.
Rostschutz

Rost entsteht, wenn Metall mit Sauerstoff (und Wasser) in Kontakt kommt. Besonders Eisen ist anfällig für Rost, der es schwächt und unansehnlich macht. Um Haushaltsgegenstände, Werkzeuge und Gebäudeteile vor Rost zu schützen, gibt es verschiedene Methoden, die auch zu Hause mit einfachen Mitteln und Haushaltschemikalien angewendet werden können.
Eine einfache Möglichkeit, Metalle vor Rost zu schützen, ist das Lackieren oder Beschichten. Du kannst Metalle wie Fahrradrahmen, Geländer oder Werkzeuge mit Rostschutzfarbe behandeln. Diese bildet eine Barriere gegen Feuchtigkeit und Sauerstoff. Besonders praktisch sind Sprühdosen, die du leicht auftragen kannst. Vor dem Lackieren solltest du die Metalloberfläche sauber machen, um sicherzustellen, dass die Farbe gut haftet.
Eine weitere Methode ist das Einölen oder Einfetten von Metallteilen. Öle wie Nähmaschinenöl, oder sogar Haushaltsfette wie Vaseline, können eine schützende Schicht auf der Metalloberfläche bilden. Diese Methode eignet sich besonders für Werkzeuge und Geräte, die oft benutzt werden, wie Schraubenschlüssel, Gartenwerkzeuge oder Türscharniere. Das Öl verhindert, dass Feuchtigkeit an das Metall gelangt.
Essig und Backpulver sind nicht nur nützliche Haushaltshelfer, sondern können auch bei der Entfernung von Rost und dem Schutz von Metallgegenständen helfen. Essig oder Zitronensäure aber auch die Phosphorsäure in der Cola reagieren mit dem Rost und lösen ihn auf, während Backpulver neutralisierend wirkt und Oberflächen reinigt.
Eine Methode, die du vielleicht von großen Metallteilen wie Zäunen oder Blechdächern kennst, ist das Verzinken. Dabei wird eine dünne Schicht Zink auf das Metall aufgetragen, die es vor Rost schützt. Diese Methode wird allerdings meist in Werkstätten durchgeführt und erfordert spezielle Geräte.
Emaille ist eine dünne Porzellanschicht, die auf Metallgegenstände gebracht wird. Auch die Gummierung von Werkzeugen und Drähten – wie bei Zäunen- dient dem Rostschutz.
Nicht alle Methoden müssen chemisch sein. Du kannst Rost auch verhindern, indem du Metalle trocken lagerst. Feuchtigkeit ist der größte Feind von Metall. Daher sollten Werkzeuge und Geräte nach dem Gebrauch abgewischt und an einem trockenen Ort aufbewahrt werden. In feuchten Räumen wie Kellern kannst du Luftentfeuchter verwenden, um die Luftfeuchtigkeit zu senken.
Zusammenfassung: Um Haushaltsgegenstände, Werkzeuge und Geräte vor Rost zu schützen, gibt es viele Methoden, die du zu Hause anwenden kannst. Lacke, Öle, Essig und Backpulver sind einfache Mittel, um Rost zu verhindern oder zu entfernen. Am wichtigsten ist jedoch, Metalle trocken zu halten, da feuchte Luft die Hauptursache für Rost ist.
Aufrufe 4473 total views
…ist eine Art der chemischen Reaktion, bei der ein Stoff mit Sauerstoff reagiert.
Die Oxidation wird in der Chemie auch als Reaktion mit Elektronenabgabe definiert. Dies setzt jedoch die Kenntnis vom Verhalten der Elemente, Ionen oder Moleküle voraus, Stabilität über die Aufnahme oder Abgabe von Elementarteilchen der Außenschale zu regeln.
Lass uns zunächst die Oxidation als Reaktion der Elemente (Metalle/Nichtmetalle) mit Sauerstoff verstehen.
Element + Sauerstoff —> Oxid des Elements
Schwefel + Sauerstoff —> Schwefeloxid
Eisen + Sauerstoff —-> Eisenoxid
Blei + Sauerstoff —-> Bleioxid
Es gibt neben Sauerstoff noch einige Elemente , die nicht auf einfachem Wege oxidiert werden können und sind die Edelgase und das Metall Gold.
Willst Du mehr wissen?
Herstellung von Goldoxid
Es bilden sich Oxide!
Wir unterscheiden die durch Verbrennen erzwungene schnelle Oxidation, und die freiwillig ablaufende langsame Oxidation (stille Oxidation), die man auch Korrosion, Rosten oder Verwittern nennt.
Verbrennt man Magnesium an der Luft, so brennt dies mit einer grellen Lichterscheinung und großer Wärmeentwicklung.
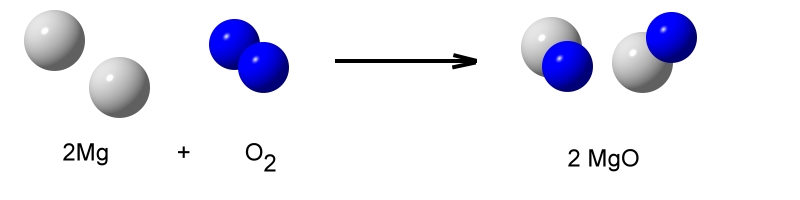
Das weiße Reaktionsprodukt heißt Magnesiumoxid.
Es wird in der Bauindustrie als Bindemittel für Schäume eingesetzt und ist als sogenannter „Säureregulator“ sogar in Lebensmitteln (E 530) als Zusatzstoff (E-Stoff) zugelassen. Auf Grund seines hohen Schmelzpunktes (2800°C) wird es zur Herstellung von feuerfesten Steinen benutzt, die als Auskleidung in Öfen von Laboren oder in Schmelzpfannen bei der Stahlherstellung benutzt werden.
weitere Oxidationen:
Aufrufe 3999 total views
Benachrichtigungen