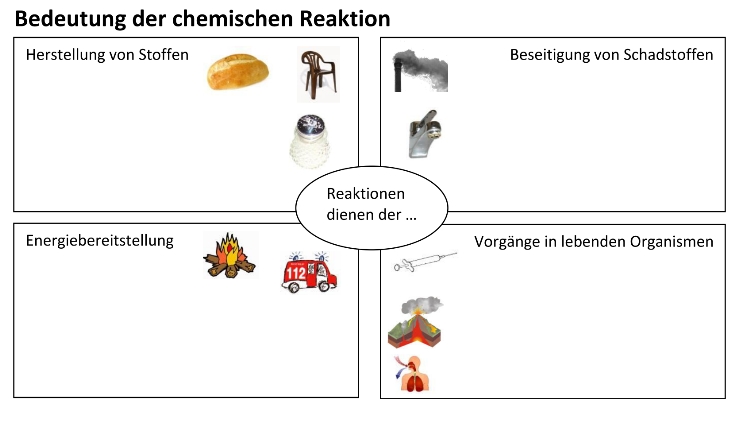
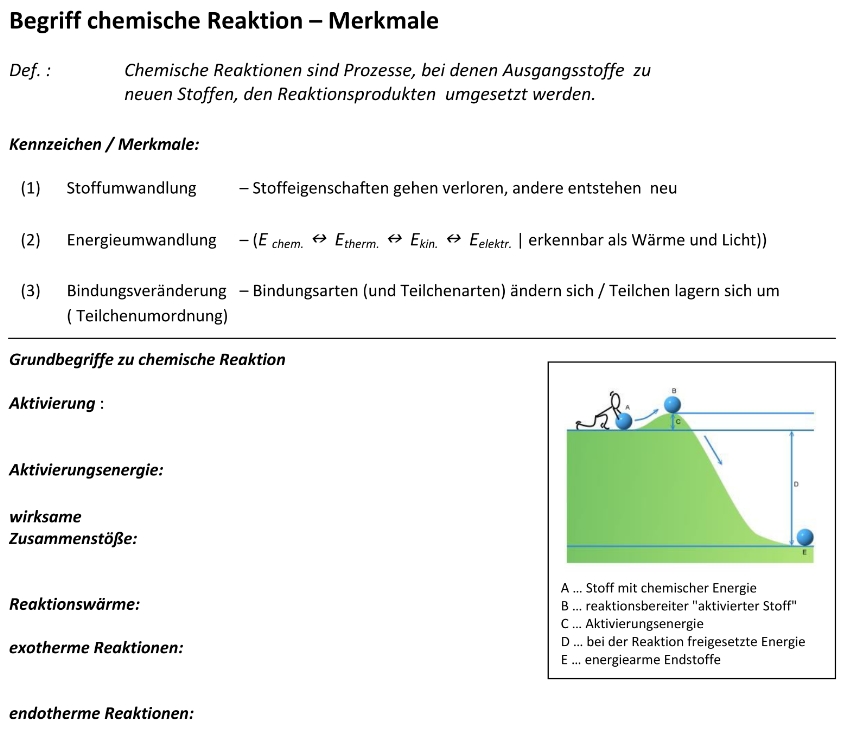
Oxidation
…ist eine Art der chemischen Reaktion, bei der ein Stoff mit Sauerstoff reagiert.
Die Oxidation wird in der Chemie auch als Reaktion mit Elektronenabgabe definiert. Dies setzt jedoch die Kenntnis vom Verhalten der Elemente, Ionen oder Moleküle voraus, Stabilität über die Aufnahme oder Abgabe von Elementarteilchen der Außenschale zu regeln.
Lass uns zunächst die Oxidation als Reaktion der Elemente (Metalle/Nichtmetalle) mit Sauerstoff verstehen.
Element + Sauerstoff —> Oxid des Elements
Schwefel + Sauerstoff —> Schwefeloxid
Eisen + Sauerstoff —-> Eisenoxid
Blei + Sauerstoff —-> Bleioxid
Es gibt neben Sauerstoff noch einige Elemente , die nicht auf einfachem Wege oxidiert werden können und sind die Edelgase und das Metall Gold.
Willst Du mehr wissen?
Herstellung von Goldoxid
Es bilden sich Oxide!
Wir unterscheiden die durch Verbrennen erzwungene schnelle Oxidation, und die freiwillig ablaufende langsame Oxidation (stille Oxidation), die man auch Korrosion, Rosten oder Verwittern nennt.
Verbrennt man Magnesium an der Luft, so brennt dies mit einer grellen Lichterscheinung und großer Wärmeentwicklung.
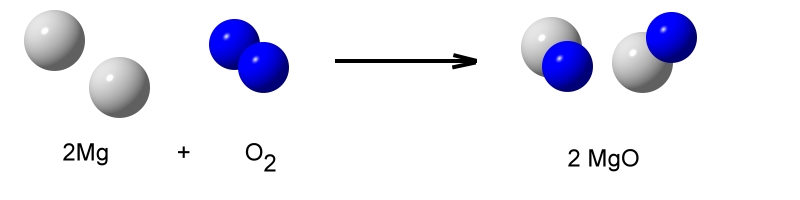
Das ergibt dann auch 2 Magnesiumoxid-Baueinheiten.
Das weiße Reaktionsprodukt heißt Magnesiumoxid.
Es wird in der Bauindustrie als Bindemittel für Schäume eingesetzt und ist als sogenannter „Säureregulator“ sogar in Lebensmitteln (E 530) als Zusatzstoff (E-Stoff) zugelassen. Auf Grund seines hohen Schmelzpunktes (2800°C) wird es zur Herstellung von feuerfesten Steinen benutzt, die als Auskleidung in Öfen von Laboren oder in Schmelzpfannen bei der Stahlherstellung benutzt werden.
weitere Oxidationen:
![]()