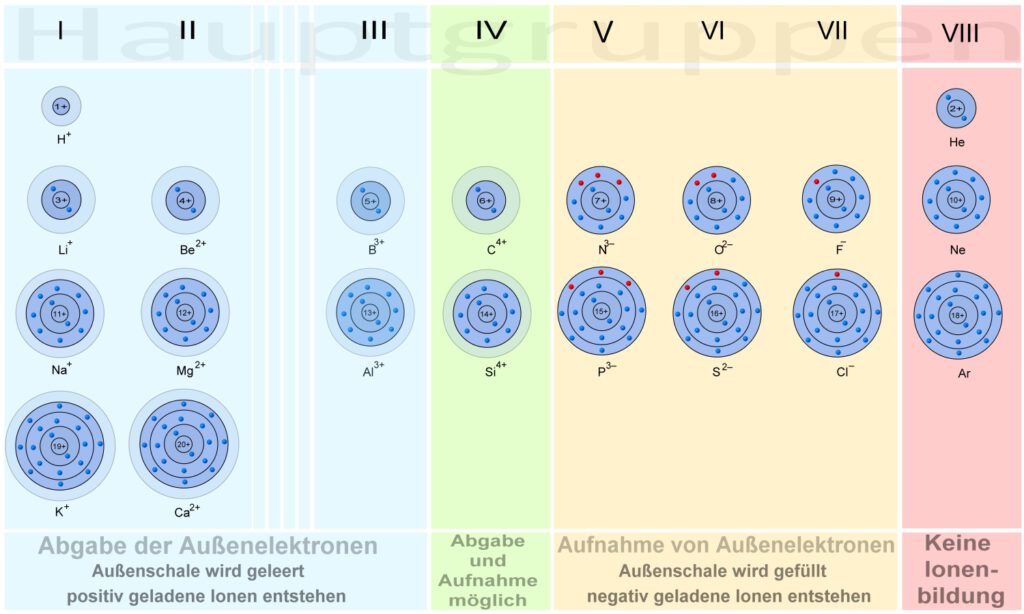
Ionenbildung
Nur wenige Elemente (Atomarten) stellen die stabilsten Zustände dar, die Edelgase. Die Edelgase sind reaktionsträge und wir finden sie nicht in Verbindungen vor. Alle anderen Elemente sind bereit, bei kleinster Beeinflussung in diese sogenannten „Edelgaszustände“ überzugehen.
Alle Atome streben nach dem Zustand, eine voll besetzte Außenschale zu besitzen.
Die Elemente bilden ihre Ionen durch die Aufnahme fremder Elektronen in ihre Außenschale oder die Abgabe von eigenen Elektronen aus ihrer Außenschale.
Beispiel: Natrium (Element 11, 1. Hauptgruppe im PSE)
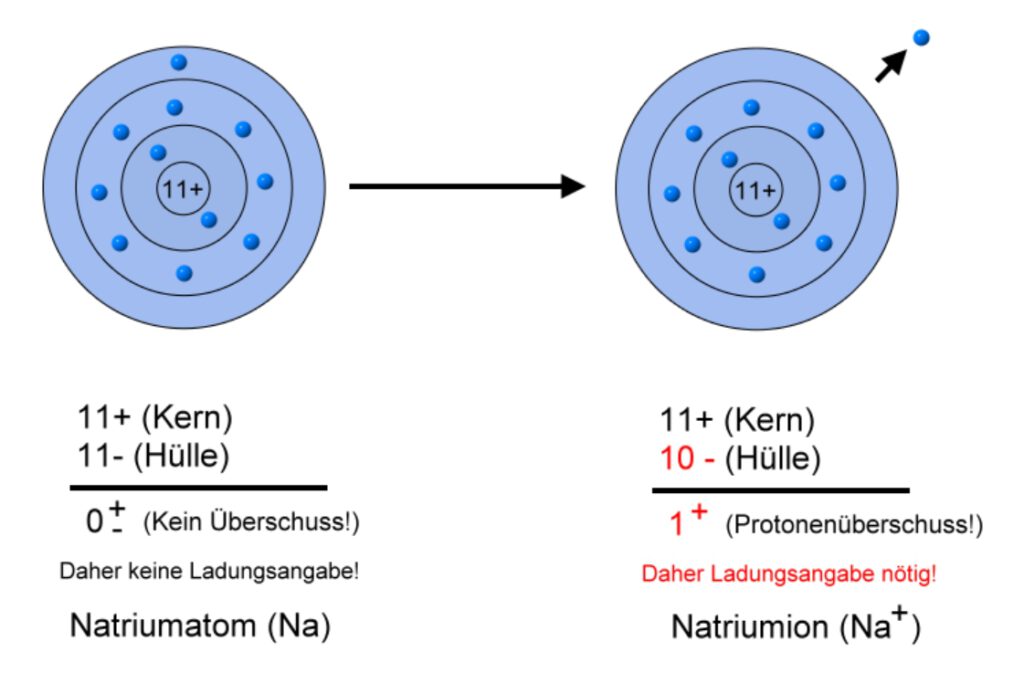
\( Na \rightarrow Na^+ + e^- \)
Das Natriumatom hat ein Außenelektron. Um eine volle Außenschale zu haben, müsste es entweder 7 Elektronen aufnehmen oder aber sein einziges Außenelektron abgeben. Der Weg des geringeren Widerstandes (Aufwandes) wird häufiger gegangen und so neigt das Natriumatom zur Elektronenabgabe. Auch im Kochsalz liegt es in seiner Ionenform \( (Na^+) \) vor.
Beispiel: Fluor (Element 9, 7. Hauptgruppe im PSE)
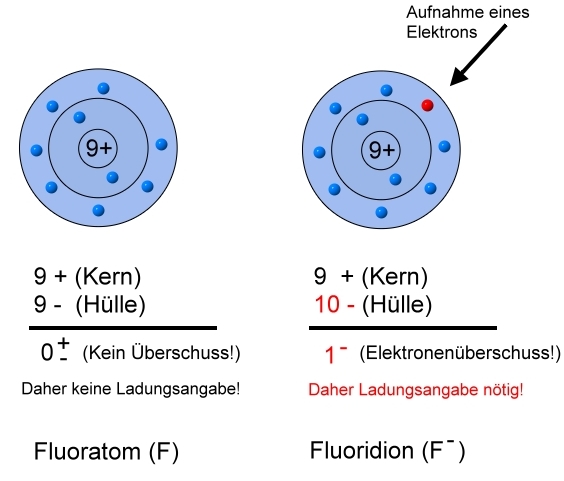
\( F + e^- \rightarrow F^- \)
Das Fluoratom hat 7 Außenelektronen. Um eine volle Außenschale zu haben, müsste es entweder die 7 Elektronen abgeben oder aber ein einziges Außenelektron aufnehmen. Auch hier wird der Weg des geringeren Widerstandes (Aufwandes) eingeschlagen und so findet man bevorzugt das Fluoridion \( (F^-) \) in der Natur.
(Sauerstofffreie Nichtmetallionen bekommen alle die Endung „id“ angehangen. Mit steigendem Sauerstoffgehalt eines Ions ändern sich die Endungen systematisch.)
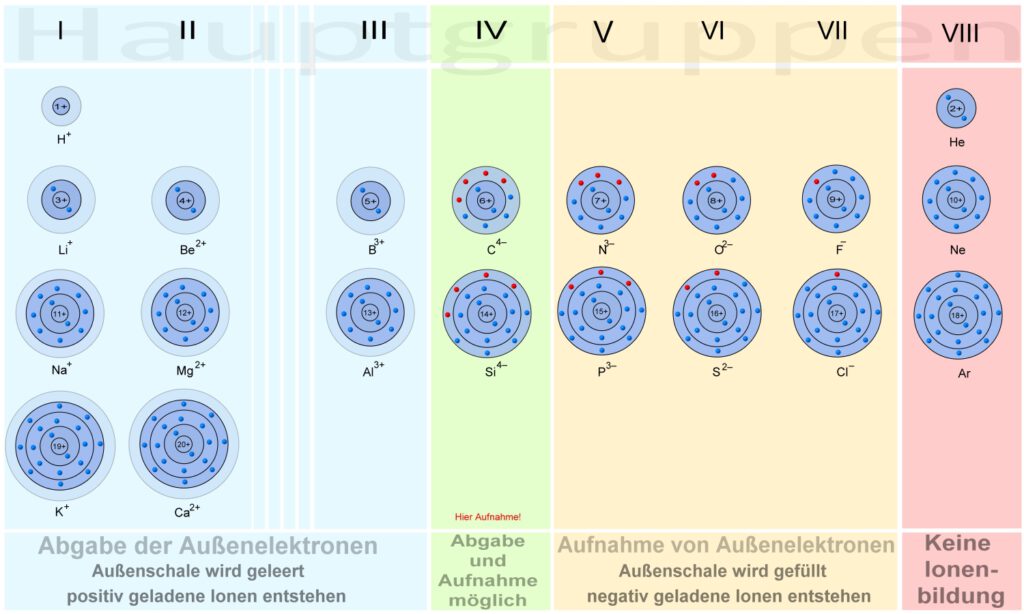
Allgemein kann man feststellen, dass die Elemente mit wenig Außenelektronen dazu neigen, ihre Außenelektronen abzugeben. Elemente bei denen die Außenschale zu mehr als der Hälfte gefüllt ist, nehmen bevorzugt Elektronen auf.
Hauptgruppen 1 bis 3 … Elektronenabgabe
Hauptgruppen 5 bis 7 … Elektronenaufnahme
Die Elemente der 4. Hauptgruppe gehen beide Wege, je nachdem welcher Reaktionspartner zur Verfügung steht.
Die Edelgase (8. Hauptgruppe) bilden keine Ionen auf natürliche Weise!
![]()