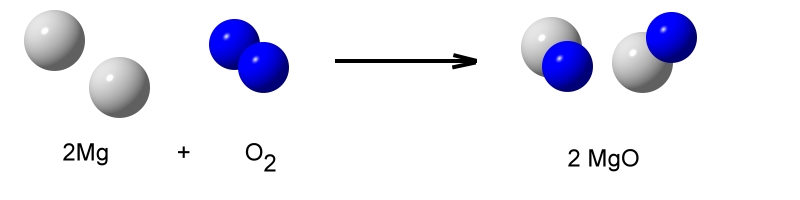
Die REDOX-Reaktion
Laufen Oxidation und Reduktion in einem System gleichzeitig ab, so nennt man diesen Prozess eine
REDuktions-OXidations –Reaktion oder kurz REDOX –Reaktion.
Voraussetzung ist, es gibt ein Oxid und einen Hilfsstoff, der den Sauerstoff des Oxids aufnehmen kann. So ein Stoff hilft, das Oxid zu reduzieren, er ist ein Reduktionsmittel und wird bei dem Prozess selbst oxidiert. Das Oxid selber ist also ein Oxidationsmittel.
Bei der RED-OX-Reaktion wird ein OXID reduziert und ein Hilfsstoff oxidiert.
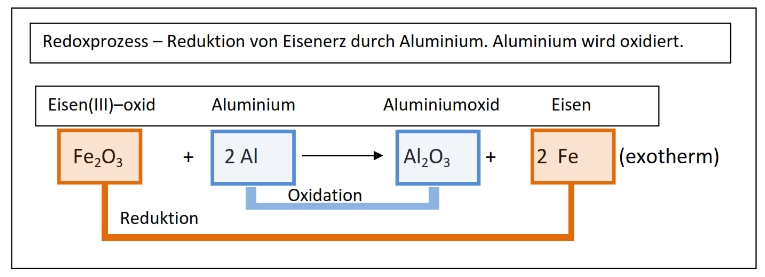
Hier wird Eisenoxid durch Aluminium reduziert. Es entsteht Eisen.
Das Aluminium nimmt dabei den Sauerstoff auf und wird zu Aluminiumoxid oxidiert.
Hans Goldschmidt – Thermitverfahren

Die Versuche des Herrn Hans Goldschmidt zu Redox-Prozessen führten vor über 100 Jahren zu neuen Erkenntnissen in der Metallurgie . Dabei wurden Oxide von stark nachgefragten Metallen, wie Chrom, Mangan und dem Halbmetall Silizium in einer Hochtemperatur-Reaktion aus ihren Oxiden hergestellt.
So stellte Herr Goldschmidt ein Verfahren vor, mit dem es möglich sein sollte, eine gebrochene Eisenbahnschiene innerhalb weniger Arbeitsstunden zu schweißen. Für damalige Verhältnisse undenkbar, da der Austausch der Schiene Tage dauerte und zum „Schweißen“ flüssiger Stahl – also 1800°C heiß – vor Ort sein müsste. Eine Demonstration des Goldschmidtverfahrens fand weltweite Aufmerksamkeit.
Heute wird dieses Verfahren – das „aluminothermische Schweißen“ – weltweit eingesetzt, da es immer noch die einfachste Art ist, flüssigen Stahl in kleinen Portionen an jedem Ort der Welt herzustellen um Schienenstöße miteinander zu verbinden und Reparaturen durchzuführen.
Der Schienenstrang wird von einer Form umgeben und vorgewärmt. Dann wird das Reaktionsgefäß mit dem Eisenoxid- Aluminium – Gemisch aufgesetzt. Die Reaktion des Gemisches wird mit einer Zündkirsche aktiviert und läuft dann stark exotherm von selbst ab. Die Schlacke – das aluminiumoxidhaltige Nebenprodukt – läuft in die seitlichen Schalen. Später wird die Gussform entfernt und die Bruchstelle entgratet.
Weiter zur Eisengewinnung durch den Hochofenprozess…
REDOX-Reaktion von Kupferoxid + Kohlenstoff
![]()