Charakter einer Lösung (sauer / basisch) (PhET)
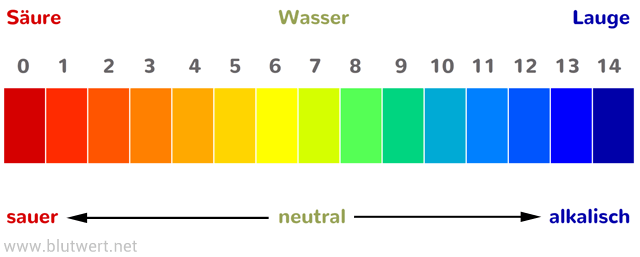
Versetzt man eine Lösung mit einem Indikator (indicare – anzeigen) , so kann man an der Färbung dieses Stoffes ablesen, ob es sich um eine Lösung mir saurem, basischem oder neutralem Charakter handelt.
Neutral sind Lösungen, die weder das typische Ion der Säuren – das Wasserstoffion(H+) – enthalten noch das Hydroxidion (OH–), welches das typische Ion aller basischen Lösungen ist.
Wir unterscheiden dabei, ob der Indikator alle Charakter (pH-Werte) anzeigen kann oder nur einen bestimmten Berech der pH-Wert-Skala.
Aufrufe 6978 total views