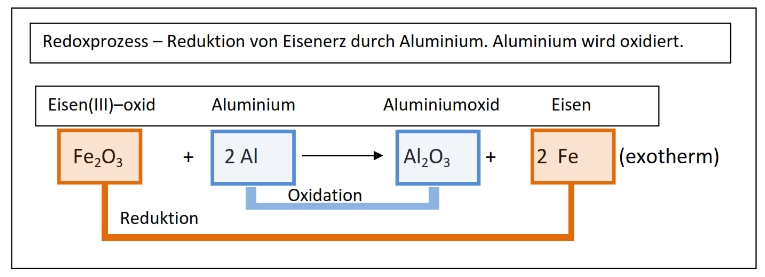
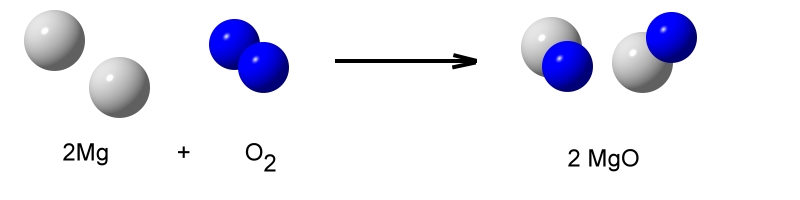
Die Reaktionswärme – exotherm / endotherm
Bei jeder chemischen Reaktion finden Prozesse der Energieumwandlung statt. Da jede Substanz ein gewisses Potential hat, das chemische Energie genannt wird, können bei Prozessen Wärme, Licht, elektrischer Strom oder Bewegungsenergie in Erscheinung treten.
exotherm
Prozesse, die mehr Energie liefern(abgeben)
als sie zugeführt bekommen, heißen „exotherm„.
Die Verbrennungsprozesse von Holz, Kohle, Benzin und Diesel, Heizöl oder Wasserstoff sind exotherme Prozesse.
Auch das Lösen von Natriumhydroxid (NaOH) in Wasser oder das Verdünnen von Säuren verlaufen unter Erwärmung des Lösungsmittels.
Anwendungsbeispiel:

Video zu den heißen Dosen
endotherm
Prozesse, die mehr Energie zugeführt bekommen,
als sie abgeben heißen „endotherm„.
Der berühmteste endotherme Prozess ist nur aktiv, wenn die Energiequelle Sonnenlicht verfügbar ist. Nachts stoppt der Prozess. Die Pflanzenwelt unseres Planeten nutzt die Photosynthese um aus Kohlendioxid und Wasser den Energiereichen Stoff Glucose(Traubenzucker) herzustellen und liefert das Nebenprodukt Sauerstoff. Lebensnotwendig für die Tierwelt.
Ein Salz, welches beim Lösen in 20°C warmem Wasser dem Lösungsmittel die Wärme entzieht, ist zum Beispiel Kaliumnitrat. Das Wasser kühlt bei Zugabe des Salzes ab. Die ersten Verfahren Erzeugung von Kälte waren die sogenannten Kältemischungen, bei denen man solche Salze mit Eis,Schnee oder Wasser mischte. So konnte man mit den unterkühlten Flüssigkeiten andere Gegenstände kühlen oder auch Wasser gefrieren. Die Idee des Kühlschrankes war nur noch einen Schritt entfernt.
Beispiel für eine endotherme Reaktion:
weitere Versuche zu „exotherm“ und „endotherm„:
Aufrufe 9523 total views