Hochofen – Quiz
![]()
Chemie kann man üben!

![]()
![]()
Am Anfang einer chemischen Reaktion steht die maximale Anzahl an Teilchen von Ausgangsstoffen (rot und grün) zur Verfügung. Mit Beginn der Reaktion finden sofort viele wirksame (reaktive) Zusammenstöße statt. Es bilden sich viele Reaktionsprodukte(grau).
Gegen Ende der Reaktion stehen nur noch wenige reaktive Teilchen der Ausgangsstoffe zur Verfügung. Die Reaktion zwischen der Teilchen wird langsamer – seltener wirksam – und „endet“.
Diese Anwendung stammt von javalab.org
![]()
Voraussetzung für das Verständnis dieses Artikels ist die Kenntnis der folgenden Grundgesetze der Chemie:
Gesetz von der Erhaltung der Masse
Gesetz der konstanten Proportionen
Gesetz der multiplen Proportionen
Betrachten wir nun die Massenverhältnisse bei chemischen Reaktionen.
Reagiert Eisen (Fe) mit Schwefel (S) , so entsteht Eisensulfid (FeS).

Hier reagieren 1mol Eisen und 1 mol Schwefel zu 1 mol Eisensulfid.
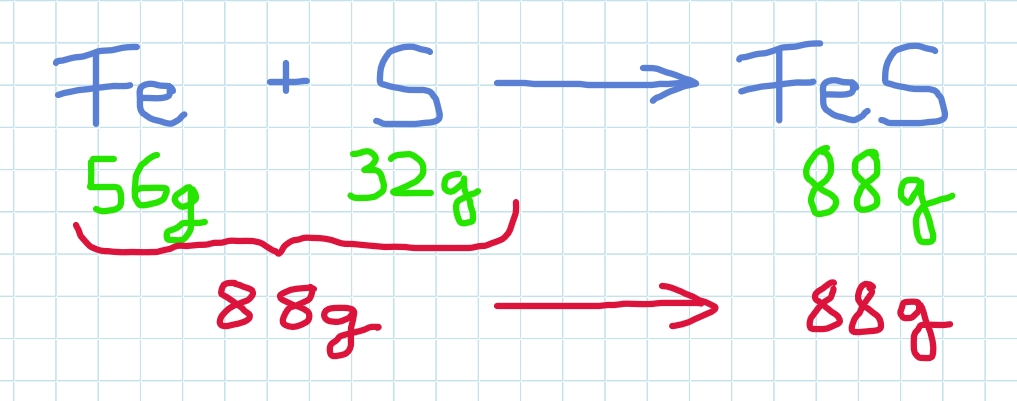
Es gilt lt. Masseerhaltungsgesetz:
Die Masse der Ausgangsstoffe ist gleich der Masse der Reaktionsprodukte!
Die eingesetzten 88g Eisen und Schwefel ergeben 88g Produkt Eisensulfid.
Halbierte man die eingesetzten Massen, so entstünde auch nur halb so viel des Produkts.
Plant man nun nur einen Teil der theoretischen Masse einzusetzen,
so erhält man auch nur einen Anteil der entstehenden Produktmasse.
Welche Masse Eisensulfid entsteht , wenn man nur 10g Eisen einsetzt?
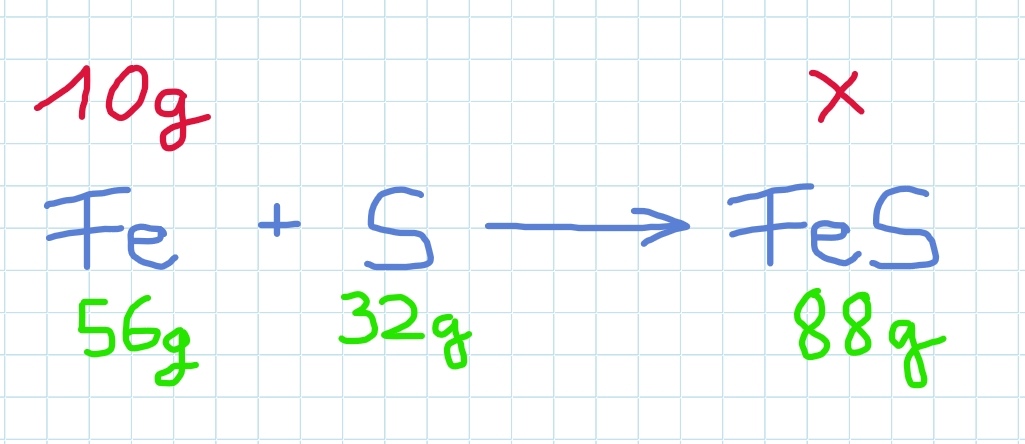
Der Schwefel spielt keine Rolle mehr…
Es entsteht eine Verhältnisgleichung für Eisen und Eisensulfid!

Nach Umstellung nach x ergibt sich…
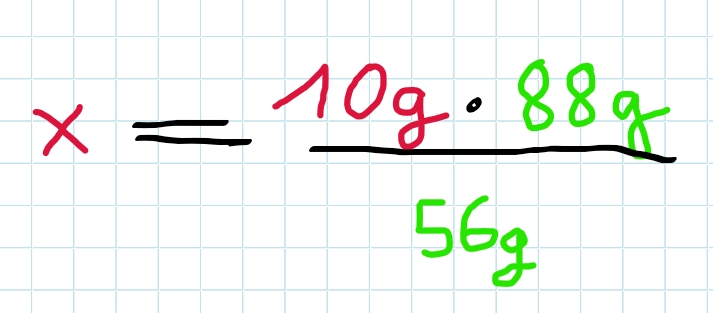
x = 15,714g
Antwortsatz:
Es entstehen also 15,4g Eisensulfid, wenn man 10g Eisen einsetzt.
Die Masse Schwefel, die einzusetzen ist, errechnet sich auf die gleiche Weise.
Ein weiteres Beispiel:
Reagieren Eisenoxid und Kohlenstoff miteinander, so entsteht Eisen und gasförmiges Kohlenstoffdioxid.
Dies geschieht in den hier dargestellten Verhältnissen:

Die einzusetzenden Massen betragen demnach…
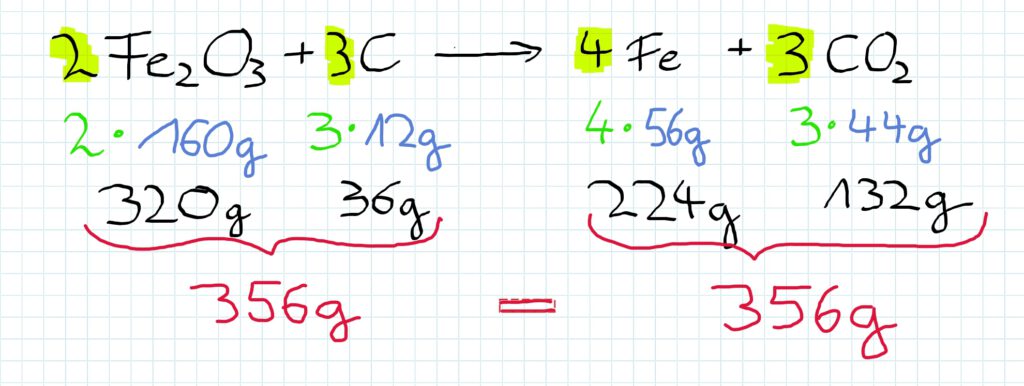
Die Koeffizienten vor den Formeln zeigen, dass ein doppelter oder gar dreifacher Anteil des Stoffes eingesetzt werden muss.
Welche Masse Eisenoxid ist einzusetzen, wenn man 10 kg Eisen produzieren will?
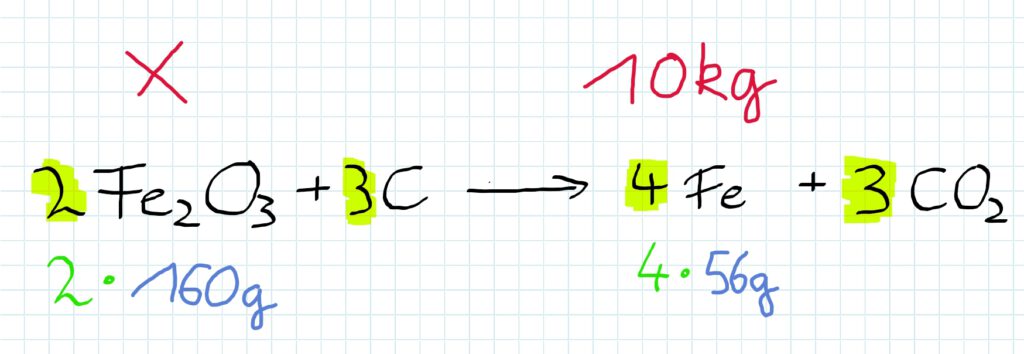
Nun ist nur noch das Verhältnis zwischen Eisenoxid und Eisen interessant…

Dafür ergibt sich die Rechenvorschrift:
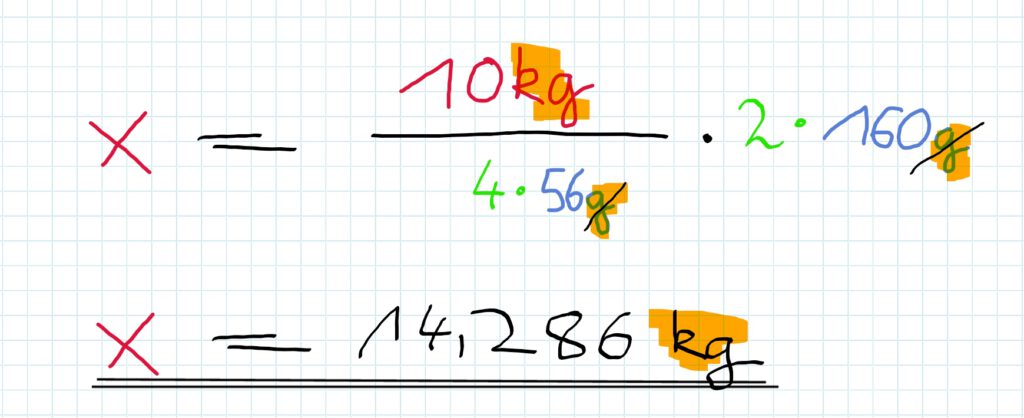
Antwortsatz:
Man muss also 14,286kg Eisenoxid einsetzen, um 120kg Eisen zu produzieren.
![]()
Bei jeder chemischen Reaktion finden Prozesse der Energieumwandlung statt. Da jede Substanz ein gewisses Potential hat, das chemische Energie genannt wird, können bei Prozessen Wärme, Licht, elektrischer Strom oder Bewegungsenergie in Erscheinung treten.
exotherm
Prozesse, die mehr Energie liefern(abgeben)
als sie zugeführt bekommen, heißen „exotherm„.
Die Verbrennungsprozesse von Holz, Kohle, Benzin und Diesel, Heizöl oder Wasserstoff sind exotherme Prozesse.
Auch das Lösen von Natriumhydroxid (NaOH) in Wasser oder das Verdünnen von Säuren verlaufen unter Erwärmung des Lösungsmittels.
Anwendungsbeispiel:

Video zu den heißen Dosen
endotherm
Prozesse, die mehr Energie zugeführt bekommen,
als sie abgeben heißen „endotherm„.
Der berühmteste endotherme Prozess ist nur aktiv, wenn die Energiequelle Sonnenlicht verfügbar ist. Nachts stoppt der Prozess. Die Pflanzenwelt unseres Planeten nutzt die Photosynthese um aus Kohlendioxid und Wasser den Energiereichen Stoff Glucose(Traubenzucker) herzustellen und liefert das Nebenprodukt Sauerstoff. Lebensnotwendig für die Tierwelt.
Ein Salz, welches beim Lösen in 20°C warmem Wasser dem Lösungsmittel die Wärme entzieht, ist zum Beispiel Kaliumnitrat. Das Wasser kühlt bei Zugabe des Salzes ab. Die ersten Verfahren Erzeugung von Kälte waren die sogenannten Kältemischungen, bei denen man solche Salze mit Eis,Schnee oder Wasser mischte. So konnte man mit den unterkühlten Flüssigkeiten andere Gegenstände kühlen oder auch Wasser gefrieren. Die Idee des Kühlschrankes war nur noch einen Schritt entfernt.
Beispiel für eine endotherme Reaktion:
weitere Versuche zu „exotherm“ und „endotherm„:
![]()